Zat Tunggal atau Zat Murni
Dari bagan di atas diketahui bahwa materi dikelompokkan menjadi dua,
yaitu zat tunggal (zat murni) dan campuran. Zat tunggal adalah bentuk materi
yang memiliki komposisi yang tetap dan sifat yang khas. Contohnya, air, emas,
oksigen, dan garam dapur.
Zat tunggal dapat dibedakan dengan zat tunggal
lainnya dengan melihat komposisinya dan dapat diidentifikasi melalui
penampakannya, baunya, rasanya, dan sifat lainnya. Zat tunggal dapat
dikelompokkan menjadi unsur dan senyawa.
a. Unsur
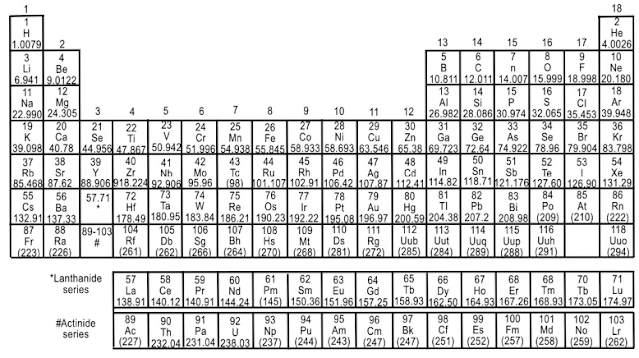
Unsur merupakan zat tunggal yang tidak dapat diuraikan lagi menjadi zatzat lain dengan reaksi kimia biasa (bukan reaksi nuklir).
Alam semesta ini
mengandung unsur yang sangat banyak, tetapi yang baru diketahui dan
dipelajari oleh para ahli adalah sebanyak 118 macam unsur dimana diantaranya
lebih dari 22 unsur adalah merupakan unsur buatan.
Daftar dari nama-nama
unsur tersebut dapat diketahui dalam Daftar Periodik Unsur-unsur Sistem
Berkala. Unsur dapat dikelompokkan menjadi 2 bagian, yaitu unsur logam dan unsur
non logam. Contoh unsur logam adalah besi, emas, perak, alumunium, tembaga,
natrium, kalium, dan magnesium.
Unsur-unsur logam tersebut memiliki sifatsifat, seperti semua unsur logam berupa zat padat (kecuali raksa yang berwujud
cair), merupakan penghantar listrik dan panas yang baik, memiliki titik leleh dan
titik lebur yang tinggi, dapat ditempa dan memiliki kilap khusus
dipermukaannya.
Sedangkan unsur non logam tidak memiliki sifat-sifat tersebut.
Contoh unsur non logam adalah oksigen, nitrogen, belerang, karbon, klorin dan
iodium.
Unsur-unsur dapat diberi nama berdasarkan nama penemunya, tempat atau
sifat unsur tersebut.
Unsur-unsur yang diberi nama berdasarkan nama
penemunya misalnya curium (ditemukan oleh Piere dan Marie Curie),
mendelium (ditemukan oleh Mendeleev), dan Einstenium (ditemukan oleh
Albert Einsten).
Unsur-unsur yang diberi nama sesuai dengan nama tempat
misalnya Californium (dari kata California), Europium (dari kata Eropa), dan
Francium (Prancis).
Unsur-unsur yang diberi nama berdasarkan sifatnya,
contohnya manganese (bersifat magnet), astatin (dari kata ”astatos” yang berarti
tidak stabil) dan kalsium (dari bahasa Latin ”Calx” yang artinya kapur).
Para ahli kimia bersepakat untuk menggunakan simbol atau lambang untuk
memudahkan penulisan unsur. Penulisan lambang unsur ditemukan oleh Jons
Jacob Berzellius 1813. Unsur dilambangkan dengan satu, dua atau tiga huruf.
Huruf pertama dari lambang unsur selalu ditulis dengan huruf kapital dan huruf
kedua atau ketiga ditulis dengan huruf kecil.
Contoh penulisan lambang unsur
cobal dilambangkan dengan Co. Nama dan lambang unsur lainnya misalnya B
Boron (B), Berilium (Be), Barium (Ba), Bismuth (Bi), Bromium (Br) dan
Berkelium (Bk), Mendelevium (Md), Einstenium (Es), Germanium (Ge),
Polonium (Po), Ameresium (Am), Californium (Cf), Curium (Cm), Nobelium
(No), Plutonium (Po), Neptunium (Np).
Jika huruf kedua dari suatu lambang adalah huruf besar maka lambang
tersebut bukanlah lambang unsur, melainkan lambang senyawa. Perhatikan
contoh berikut : Co adalah lambang unsur cobal sedangkan CO adalah senyawa
karbon monooksida; Hf adalah lambang unsur hafnium sementara HF adalah
senyawa Hidrogen Fluorida.
b. Senyawa
Senyawa adalah zat kimia yang terbentuk dari dua atau lebih unsur. Oleh
karena itu, senyawa dapat diuraikan menjadi zat lain yang lebih sederhana
melalui proses kimia.
Perhatikan contoh berikut: molekul air yang memiliki
rumus kimia H2O merupakan suatu senyawa yang tersusun dari 2 buah atom
hidrogen dan 1 buah atom oksigen. Molekul air dihasilkan dari reaksi antara gas
hidrogen dan gas oksigen, menurut persamaan reaksi berikut:
2H2(g) + O2(g) => 2H2O(c)
Melalui proses elektrolisis, molekul air yang terbentuk dari reaksi tersebut
dapat diuraikan kembali menjadi gas hidrogen dan gas oksigen.
2H2O(c) => 2H2(g) + O2(g)
Sifat zat yang menyusun senyawa berbeda dengan sifat senyawa yang
terbentuk. Pada contoh di atas, gas oksigen dan gas hidrogen berwujud gas dan
mudah terbakar, sedangkan air berwujud cair dan digunakan untuk
memadamkan api.
Hal lain yang harus diperhatikan ketika membahas tentang senyawa adalah
bahwa senyawa terbentuk dari unsur-unsurnya dengan perbandingan yang tetap.
Berdasarkan hasil eksperimen yang dilakukannya, Joseph Louis Proust
menyatakan bahwa perbandingan massa unsur-unsur yang menyusun suatu
senyawa adalah tetap.
Postulat tersebut dikenal sebagai hukum perbandingan
tetap. Sebagai contoh, perbandingan massa gas hidrogen dengan massa gas
oksigen dalam air adalah 1:8, di mana rumus air adalah H2O, massa atom (MA)
H = 2 × MA, Hidrogen (1) sedangakan O = 1 × massa oksigen 16). Jadi, 2 : 16 =
1 : 8.
Senyawa kimia dapat dikelompokkan menjadi dua, yaitu senyawa yang
berasal dari benda tak hidup yang disebut senyawa anorganik dan senyawa yang
berasal dari benda hidup yang disebut senyawa organik.



Posting Komentar untuk "Zat Tunggal atau Zat Murni"